Symposium & Assemblée Générale
Mardi 19 Octobre 2022 Chateauform « Les Jardins de Saint Dominique » Paris 7ème

Participants : Dr ADIKO Didier, Dr AME Shanti, Dr BALSAT Marie, Pr BERGER Marc, Dr CAYSSIALS Emilie, Dr CAYUELA Jean-Michel, Dr CHOMEL Jean-Claude, Dr CONY-MAKHOUL Pascale, M. DELOIRE Alexandre, Mme DOUBLET Charlotte, Dr DUBRUILLE Viviane, Dr DULUCQ Stephanie, Dr ESCOFFRE Martine, Dr GARDEMBAS Martine, Dr HAYETTE Sandrine, Dr HEBIBI Zehaira, Dr HUGUET Françoise, Dr JOHNSON ANSAH Hyacinthe, Dr LAPIERRE Léopoldine, Dr LEGROS Laurence, Dr LIU Jixing , Dr MACHET Antoine, Pr MAHON François-Xavier, Mme MANNEVY Barbara, Pr MICHALLET Mauricette, Pr MILLOT Frédéric, Dr NICOLINI Franck , Dr PENOT Amélie, Dr REA Delphine, Pr ROCHE-LESTIENNE Catherine, Pr ROUSSELOT Philippe, Dr ROY Lydia, Dr SIMONET-BOISSARD Marion, Dr SLOMA Ivan, Dr TIGAUD Isabelle, Pr TULLIEZ Michel
Excusés : Dr CHARBONNIER Aude, Pr GUILHOT François, Dr GUILHOT Joëlle
Stamp inhibitor : Bases biologiques et données cliniques
Dr Delphine REA, Service d’hématologie clinique, Hôpital Saint-Louis, Paris

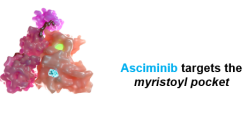
L’asciminib est un inhibiteur allostérique de BCR::ABL1. Il inhibe l’oncotyrosine kinase en
occupant le site de fixation du groupement myristoyl d’ABL1, fermant ainsi la protéine en conformation inactive. Du fait de son mode d’action, il est hautement sélectif in vitro, contrairement aux ITK compétitifs de l’ATP. Son spectre d’action contre les différents mutants d’ABL1 émergents sous ITK compétitifs de l’ATP reste à préciser mais l’on sait d’ores et déjà que l’asciminib peut combattre les mutants de résistance T315I notamment, offrant ainsi une alternative au ponatinib.
Après un développement en phase 1 qui a démontré l’intérêt de l’asciminib chez des patients intolérants ou résistants à plusieurs ITK compétitifs de l’ATP, un profil de tolérance très favorable à faible ou forte dose, et une efficacité en cas de mutation T315I, l’asciminib a été évalué face au bosutinib à partir de la 3ème ligne dans la LMC-PC résistante ou intolérante aux ITK précédents. Les résultats de cette étude d’enregistrement (essai ASCEMBL), ont permis l’octroi d’une AMM. En résumé, l’efficacité et la tolérance de l’asciminib à 80mg /jour sont significativement supérieures à celle du bosutinib à 500 mg/j. De plus, les réponses moléculaires de type MR2, MR3, MR4 ou MR4.5 obtenues semblent pérennes.
Les patients atteints de LMC se voient donc offrir une nouvelle opportunité de traitement. La place exacte de l’asciminib dans l’arsenal thérapeutique en dehors de la 3ème ligne, et les modalités optimales d’utilisation du médicament devront être précisés et de nombreuses études de par le monde s’attellent déjà à répondre à ces questions.
Intérêt de la PCR digitale pour les patients en arrêt de traitement
Dr Stéphanie DULUCQ, Laboratoire d’hématologie, hôpital Haut Lévêque, CHU de Bordeaux, Pessac.
La PCR digitale, un nouvel outil :
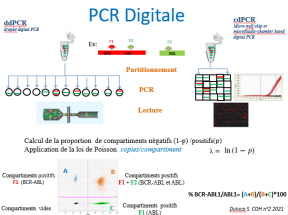
Il s’agit d’une nouvelle génération de PCR reposant sur la quantification absolue des acides nucléiques après partitionnement du mélange réactionnel
On parle de ddPCR (digital droplet PCR) lorsque le partitionnement se fait par émulsion et génération de nano-gouttelettes et de dcPCR (digital chip PCR) lorsque le partitionnement se fait dans des milliers de puits répartis sur un support solide.
Intérêts principaux :
– Le multiplexage, c’est-à-dire la détection d’au moins 2 gènes par « puits » – La détermination d’un ratio (% BCR-ABL1/ABL1= (A+B)/(B+C)*100) qui donne un taux de transcrit.
– La sensibilité de la technique qui permet de détecter de plus faibles quantités de matrice
– La division de l’échantillon qui permet d’isoler et de mieux détecter le gène d’intérêt du gène contrôle
– Une sensibilité plus importante (plus de résultats positifs en PCR digitale qu’en RT-PCR)
– Une bonne reproductibilité (moins de variabilité inter-laboratoires)
Limites de sensibilité :
– Elle est dépendante du nombre de compartiments, du bruit de fond (auto hydrolyse des sondes) ainsi que de la quantité d’ADN analysé.
– Elle ne permet pas de descendre en profondeur de réponse mais seulement de mieux détecter la ou les copies restante(s).
Intérêt de la PCR digitale dans les stratégies d’arrêt de traitement :
Compte-tenu d’une meilleure sensibilité par rapport à la RT-qPCR, elle pourrait avoir un intérêt dans la prédiction de la rechute moléculaire chez des patients atteints de LMC en réponse moléculaire profonde stable dans le contexte d’une tentative d’arrêt de traitement.
Les premières publications portant sur des essais incluant des patients ayant un transcrit indétectable en RT-qPCR semblent aller dans ce sens, en mettant en évidence :
– Une meilleure TFR lorsque la PCR digitale était négative au moment de l’arrêt de traitement,
– Un risque de rechute plus important en présence d’une PCR digitale au dessus du seuil de 0.0023%
– Une meilleure discrimination en lien avec la présence d’un signal par quantification de BCR-ABL
Certaines méta-analyses restent cependant difficiles compte-tenu de cut-off variables selon les études.
Au total :
La PCR digitale est un nouvel outil sensible et précis, pouvant avoir un intérêt potentiel dans la stratégie d’arrêt de traitement mais qui reste à confirmer par l’analyse d’autres cohortes. Sa place dans l’algorithme thérapeutique reste encore à définir.
Rappel :
Le projet “PETALs ddPCR : PEgylated interferon-a2a and TAsigna® for first-Line therapy of chronic phase CML patientS digital droplet PCR”, soumis dans le cadre de l’Appel d’Offres Force Hémato 2018 est toujours en cours.
11H00 : Retour d’expérience de la région Aquitaine : Faisabilité d’un suivi dématérialisé dans la LMC
Dr Gabriel ETIENNE, Service d’hématologie, Institut Bergonié, Bordeaux Dr Stéphanie DULUCQ, Laboratoire d’hématologie, Hôpital Haut Lévêque,CHU de Bordeaux, Pessac
Rappel du contexte :
– L’espérance de vie des patients atteints de LMC est proche de celle de la population générale,
– L’incidence de la maladie reste stable mais sa prévalence est en augmentation, – Un pourcentage croissant de patients est en arrêt de traitement (20% environ) avec une nécessité de suivi régulier car les rechutes tardives restent possibles, – La survenue de la pandémie de COVID19 a induit des changements indispensables dans la prise en charge des patients -> Alternance d’un suivi présentiel / distanciel.
Organisation du suivi à distance :
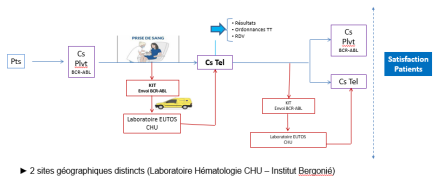
Organisation des prélèvements à distance :
– Les prélèvements sont réalisés au domicile ou en laboratoire de proximité, – Ils sont envoyés par voie postale sous triple emballage, en enveloppes bleues, – Afin de garantir la qualité et l’exploitabilité des prélèvements, ils doivent être
réalisés en début de semaine, expédiés accompagnés des formulaires dédiés et porter mention de la date à laquelle ils ont été réalisés. NB : Les prélèvements arrivent généralement en moins de 4 jours, ce qui est sans conséquence sur l’ARN. – La centralisation des échantillons reste sur le CHU
➔ L’association du logiciel « Panda LAB » permet de simplifier la gestion en distanciel : Transmission de documents, génération d’ordonnances, envoi des résultats etc.
Données patients / Satisfaction :
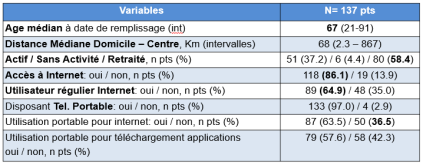
144 patients, 224 prélèvements à distance :

144 questionnaires envoyés – 137 retournés :
Au total :
– Points forts :
• Fiabilité du système (Kits)
• Accueil favorable des patients
• Pérennisation du biobanking
• Coûts moindres
– Points Faibles :
• Circuit des documents patient/médecin à améliorer, outils à mettre en place • Diversification des acteurs à instaurer : rôle des IPA ?
– Perspectives :
• Positionnement plus précoce dans la prise en charge
• Développement au niveau oligo/multicentrique
11H25 : Méta-analyse des associations ITK etInterféron
Pr François-Xavier MAHON, Service d’hématologie, Institut Bergonié, Bordeaux Dr Lydia ROY, Service d’Hématologie, Hôpital Henri Mondor, Créteil
Rappels :
Méta-analyse : Méthode d’analyse statistique combinant les résultats d’une série d’études indépendantes sur un ou plusieurs problèmes donnés
Intérêts principaux :
• Augmentation du nombre des cas étudiés
• Interprétation globale d’études parfois contradictoires
• Détection des biais des études inclues
Revue systématique :
• Rassembler toutes les études pertinentes sur un problème clinique donné • Interprétation globale d’études parfois contradictoires
• Démarche scientifique rigoureuse et reproductible : Déterminer la question de recherche, rechercher et sélectionner les études pertinentes, évaluer la qualité de chaque étude
• Synthétiser les résultats obtenus d’un point de vue qualitatif et quantitative, méta analyse
Evolution du nombre de méta-analyses :
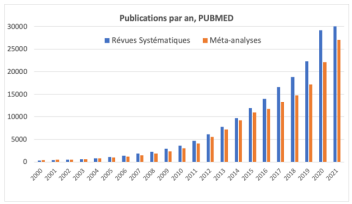
Combinaison ITK + IFN : Rationnel :
➢ A l’ère de l’IFN
• Sous-catégorie de patients « guéris » après IFN
➢ A l’ère des ITK
• Mécanismes d’action de l’IFN potentiels différents et complémentaires : Mise en cycle CSL, stimulation de la réponse immunitaire autologue contre
la LMC, rôle sur la niche leucémique ?
➢ A l’ère des arrêts de traitement post ITK
• EuroSKI : Meilleure probabilité de TFR @ M6 pour les pts ayant eu un
traitement par IFN préalable à l’ITK
Une question centrale dans les essais du groupe :
Les résultats actuels :
⇒ Petites doses de Peg-IFN suffisantes, durée >=12 mois
⇒ Optimisation de la tolérance association avec 3 ITKs
⇒ Forte proportion de patients en réponse moléculaire profonde précoce ⇒ Augmentation de la proportion de patients en TFR ?
Les problèmes d’accessibilité à l’IFN :
➢ Interféron alpha 2a (Introna®) -> AMM – Arrêt de commercialisation 08/2020 ➢ Interféron alpha 2b (Roferon®) -> AMM – Arrêt de commercialisation 06/2020 ➢ Peg-Interféron alpha 2a (Pegasys®) commercialisé (Cheplapharm), hors AMM ➢ RoPegIFN alpha2b (Besremi®) pas d’AMM (PV), non disponible en France
Evolution du paysage des patients en 3ème ligne : Observatoire 3ème ligne et T315 Dr Franck NICOLINI, Service d’hématologie clinique, Centre Léon Bérard, Lyon
Rappel : Bien que les ITKs aient considérablement réduit les risques d’évolution de la LMC vers une phase aiguë ou blastique, certains patients connaissent malgré tout des échecs thérapeutiques en raison notamment d’une résistance ou d’une intolérance au traitement. Ce risque augmentant avec le nombre de lignes de traitement successives.
La résistance aux ITKs :
Elle peut être prévisible dès le diagnostic, principalement en cas d’anomalies ou de symptômes cliniques. Elle est favorisée par l’instabilité génétique inhérente à cette leucémie.
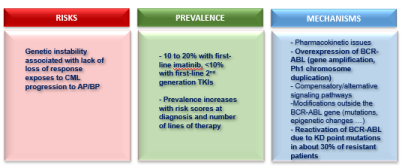
Critères de résistance définis par l’ELN et la NCCN :
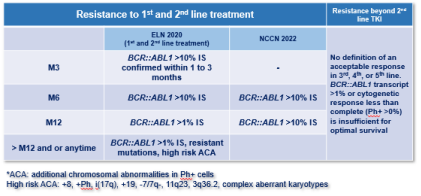
Intolérance aux ITKs :
Plusieurs EI peuvent être évoqués d’emblée en fonction de la dose de traitement administrée et de la pharmacologie, mais la définition d’intolérance reste compliquée :
Définition :
Un ou plusieurs des effets suivants :
– Toute toxicité non hématologique mettant en jeu le pronostic vital. – Toute toxicité non hématologique de grade 3 ou 4 réapparue malgré des soins de soutien optimaux et une réduction de la dose.
– Toute toxicité hématologique de grade 3 ou 4 ne répondant pas à des soins de soutien optimaux et nécessitant une réduction de la dose inférieure à la dose minimale efficace.
– Toute toxicité non hématologique de grade 2 persistant pendant plus d’un mois malgré des soins de soutien optimaux.
Prévalence : Entre 9 et 25 % des patients abandonnent leur IKT de 1ère ligne en raison d’effets indésirables.
Mécanismes : Toxicité directe, inhibition non spécifique des kinases ou des non-kinases (effets hors cible), rarement anaphylaxie.
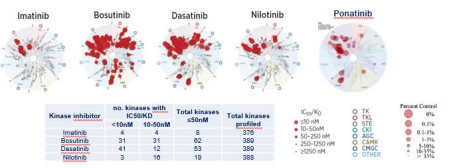
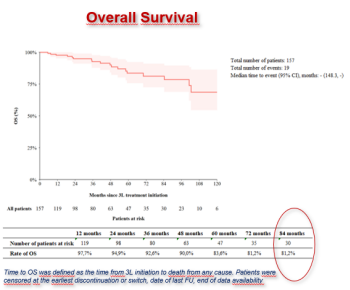
Les études de » vie réelle » de patients atteints de LMC ≥ 2ème ligne ont montré : – Une réponse moléculaire chez 54 % des patients (temps médian pour obtenir une RMM : 21 mois).
– Une MR4.0 atteinte par 40 % des patients (temps médian pour atteindre MR4.0 : 58 mois)
– Une MR4.5 atteinte par 25 % des patients (temps médian pour MR4.5 : non atteint).
Comment « contourner » les échecs de traitement par ITKs ? :
Utiliser de nouvelles molécules :
t des profils d’efficacité et de sécurité acceptables qui pourraient améliorer l’issue du traitement chez les patients en échec après au moins deux lignes de traitement.
Optimiser l’utilisation de molécules connues (Essai OPTIC) en conservant une dose efficace tout en diminuant certains EI :
L’optimisation de l’utilisation du ponatinib par une nouvelle approche de réduction de la dose basée sur la réponse tout en minimisant la toxicité (cardio-vasculaire ou cutanée notamment) est réalisable mais il faut garder à l’esprit que la meilleure dose initiale chez les patients hautement résistants reste 45 mg/J, particulièrement en présence d’une mutation T315I.
Au total, l’échec (par résistance ou intolérance) au-delà de la 1ère ligne de traitement, reste un événement fréquent qui se caractérise par des mécanismes complexes pouvant conduire à l’utilisation d’autres ITKs ou à faire évoluer la pratique clinique en optimisant le traitement, actuellement par ponatinib mais qui pourrait sans doute être appliquée à d’autres ITKs.
